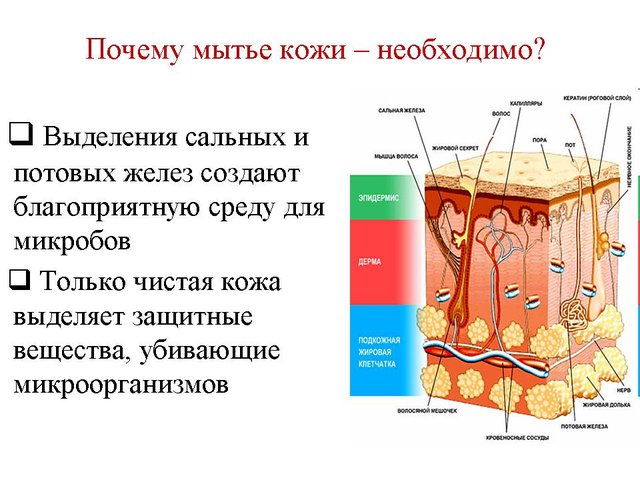
Мыло гигроскопичное вещество — универсальное моющее средство. На этапе принятия решения о закупке мыла, учитывается не только выгодная цена, но и качество мыла. Как же человеку, не знающему тонкости производственного процесса мыловарения определить качество готового мыла?
Ответ прост: хорошее мыло сварено из лучших сортов жиров, а именно животного происхождения. Качественное мыло производится из натуральных растительных масел: кокосового, льняного, хлопкового, пальмового. Следовательно жирные масла выделяют из растительных продуктов, а также животных, например из свиного сала или рыбьего жира.
А низкосортное мыло изготавливают соответственно из искусственных заменителей — это канифоль или нафтеновые кислоты (продукты переработки нефти). Избыточное содержание искусственных компонентов в мыле превращает пушистую мыльную пену в липкую смесь, мыло липнет не только к рукам, но и оставляет липкий налет. Особенно такая ситуация с хозяйственным мылом.
На качество мыла влияет процентное содержание в нем жирных кислот, высший сорт всегда имеет высокое значение.
Мыло производится путем кипячения в воде жирных масел с щелочами. В качестве щелочи идет каустический поташ и каустическая сода. Во время кипячения образуются глицерин и соли жирных кислот, т.е. мыл или мыльный клей. Он требует удаления примесей и на этом этапе важна степень очистки. Примеси удаляют соляным раствором. Если мыло плохо очищено, то оно не дает хорошую пену, а так же может вызвать раздражения кожи.
С полученного после очистки мыльного слоя и производят разные сорта мыл.
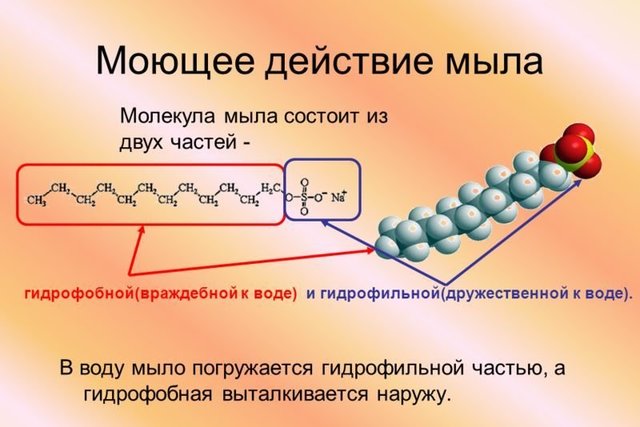
Мыло справляется с загрязнениями за счет содержания в нем щелочи, которая нейтрализует жир и иные загрязнения. Щелочь вступает в реакцию с солями загрязнений, во время химической реакции, мыло меняет поверхностное натяжение воды, образуются отрицательно заряженные ионы, которые отскакивают от очищаемой поверхности. А мыльные молекулы обволакивают частички грязи и препятствуют тому, что бы грязь не прилипла вновь. Далее смываются мыльной пеной, по этому пена так важна, нет пены — плохо смыто загрязнение. Загрязняющие частицы застревают в пене и смываются водой.
Добавки, что есть в мыле придают ему те или иные полезные свойства и назначение (отбеливание, увлажнение, очищение и т.д).
Твердое мыло получают из насыщенных жиров. Для этого жидкие растительные масла при помощи водорода насыщают до твердых насыщенных жиров. Для жидкого мыла, наоборот, применяют жидкие масла. Помимо твердого и жидкого мыла, есть еще и порошкообразное мыло или так называемая мыльная стружка.

Для справки:
МЫЛА, соли высших жирных (С8-С18), нафтеновых и смоляных кислот; одни из основных моющих средств. Технические смеси водорастворимых (калиевых, натриевых, аммониевых и три-этаноламмониевых) солей этих кислот называются щелочными мылами, водонерастворимые соли, содержащие металлы II, III и др. гр. (например, Са, Mg, Ni, Mn, Al, Co, Pb и др.) — металлическими.
Щелочные мыла получают главным образом из стеариновой, пальмитиновой, лауриновой, олеиновой, нафтеновых кислот, канифоли и таллового масла.
Индивидуальные соли высших жирных кислот — кристаллические вещества; плотность около 1,05 г/см3, температура пл. 225-260 °С. В зависимости от условий кристаллизации мыла существуют в моноклинной или ромбической форме; последняя характеризуется лучшей растворимостью в воде. При наличии в мылах ничтожных количеств воды температура плавления понижается до 100°С. Соли ненасыщенных жирных кислот лучше растворяются в воде и труднее кристаллизуются, чем соли насыщенных. Безводные мыла гигроскопичны; их гигроскопичность зависит от природы кислотного остатка и связанного с ним катиона. При повышенных температурах мыла и вода смешиваются во всех отношениях; при комнатной — водные растворы мыл образуют твердые гели, содержащие воду, максимальное количество которой зависит от природы жирной кислоты и иона металла. При определенной концентрации мыла образуют мицеллярные растворы и проявляют макс. моющее действие. Важная характеристика мыл — концентрация, при которой происходит образование мицелл, называется критической концентрацией мецеллообразования. В области критической концентрации свойства растворов мыл (поверхностное натяжение, электрическая проводимость, осмотическое давление и др.) резко изменяются.
С увеличением молекулярной массы растворимость мыла в воде уменьшается. Растворимость в высокомолекулярных мылах повышается в присутствии низкомолекулярных. В зависимости от природы катиона мыла по растворимости в воде располагают в ряд: NH+4 > К+ > Na+ > Li+. Мыла в водных растворах гидролизуются. С повышением температуры и понижением концентрации, и величины рН гидролиз усиливается: водные растворы мыл имеют щелочную реакцию. С увеличением молекулярной массы способность мыла к гидролизу возрастает, причем мыла насыщенных жирных кислот подвергаются гидролизу сильнее, чем ненасыщенных; добавление щелочи к раствору мыла подавляет гидролиз. Под действием минеральных кислот мыла разлагаются с выделением свободных жирных кислот.
Молекулы мыла, адсорбируясь на границе раздела фаз, снижают поверхностное натяжение. В водных растворах мыла характеризуются равновесными переходами: молекулярный раствор ⇌золь ⇌гель, что характерно для полуколлоидов (семиколлоидов). Образование мицеллярных растворов мыла наблюдается выше некоторого критического значения температуры — так называемой точки Крафта, которая обычно несколько ниже температуры плавления твердого мыла. При температурах ниже точки Крафта гидратированное твердое мыло образует набухший гель, равновесный с истинным раствором, в точке Крафта — коллоидные частицы-мицеллы; при этом общая растворимостьмыла значительно возрастает. С увеличением молекулярной массы мыла точки Крафта смещаются в область более высоких температур.
По способу получения мыла делят на клеевые, ядровые и пилированные, по целевому назначению: на хозяйственные, туалетные, технические, спец. и медицинские, по товарной форме: на твердые, жидкие и пастообразные.
Процесс получения мыл (мыловарение) состоит из варки мыла и придания ему товарного вида (охлаждение, формование, штамповка, упаковка). При варке мыла исходные жиры омыляют водным раствором NaOH при кипячении с последним нейтрализацией продукта омыления (жирные кислоты) раствором Na2CO3 при кипячении и интенсивном перемешивании; при этом нейтрализуется до 70% жирных кислот. Оставшиеся жирные кислоты и нейтральные жиры обрабатывают раствором щелочи. На этой стадии образуется концентрированный раствор (так называемый мыльный клей), в котором поддерживается некоторый избыток щелочи (примерно 0,2%) для подавления гидролиза. Клеевые мыла получают путем охлаждения концентрации водных растворов мыла без нарушения однородности раствора; они содержат 30-50% основного вещества. Охлажденную массу режут на куски.
В процессе получения ядрового мыла в мыльный клей вводят концентрированный раствор электролита (NaCl, NaOH). При этом происходит высаливание мыла и масса разделяется на два слоя. Верхний, слой представляет собой очищенное мыло-«ядро» с содержанием мыла после отстаивания не менее 60%. Нижний слой, так называемый подмыльный щелок, представляет собой раствор электролита, содержащий небольшие количества мыла, примеси, присутствующие в исходном сырье, а также глицерин (при получении мыла из нейтральных жиров). Из под-мыльного щелока извлекают мыла и глицерин. Выделенное «ядро» очищают и осветляют промывкой раствором электролита.
Пилированное мыло — высший сорт мыла; получают из ядрового путем высушивания последнего перетиранием на вальцах специальной (пилирной) машины. Содержание основного вещества в таком мыле повышается до 72-74%, улучшается структура мыла, его устойчивость к усыханию, прогорканию и действию высоких температур при хранении.
Хозяйственное мыло получают охлаждением мыльного клея, после чего плоские твердые плиты мыла разрезают на резальных машинах на куски, которые маркируют на автоматических штамп-прессах, а затем упаковывают в тару. Более современны и производительны механизированные вакуумные установки для охлаждения и формования непрерывного действия. Твердые хозяйственные мыла в зависимости от сорта содержат 40-72% осн. вещества, 0,1-0,2% своб. щелочи, 1-2% своб.карбонатов Na или К, 0,5-1,5% нерастворимого в воде остатка. Для производства твердого туалетного мыла используют «ядро», сваренное из лучшей по составу жировой основы, содержащей 72-80% животных жиров, кокосовое масло или соответствующие фракции синтетических жирных кислот. В туалетное мыло обычно вводят различные отдушки и красители.
Жидкие туалетные мыла содержат 18-20% калиевых или калиево-натриевых мыл в водно-спиртовом растворе (содержащие С2Н5ОН 10-15%).
Порошкообразные мыла выпускают как в чистом виде, так и в смеси со щелочными электоролитами (Na2CO3, триполифосфаты и силикаты Na и др.), которые добавляют для умягчения воды; получают в сушильно-распылительной башне, продуваемой воздухом, куда через распылительные форсунки или с помощью вращающегося диска попадает горячий водный раствор мыла в смеси с электролитами. Применение электролитов снижает расход мыла и повышает эффект стирки.
Хозяйственные и туалетные мыла — основные бытовые моющие средства. Технические мыла — загущающий компонент большинства мыльных смазок, применяемых в узлах трения, а также защитных и уплотнительных смазок.
Глоссарий:
Гигроскопичность (от гигро… и греч. skopeo — наблюдаю), свойство материалов поглощать (сорбировать) влагу из воздуха. Гигроскопичностью обладают: смачиваемые водой (гидрофильные) материалы капиллярно-пористой структуры (древесина, зерно и др.), в тонких капиллярах которых происходит конденсация влаги; хорошо растворимые в воде вещества (пищевая соль, сахар, концентрированная серная кислота и др.), особенно химические соединения, образующие с водой кристаллогидраты. Количество поглощённой пористым материалом влаги (гигроскопическая влажность, Wгиг.) возрастает с увеличением влагосодержания воздуха, достигая максимума при относительной влажности воздуха 100%. Для древесины максимальная Wгиг. ~30% (по массе), для пшеницы ~36%. Знание гигроскопичности материала важно для расчёта процессов сушки и увлажнения: гигроскопичность учитывается при длительном хранении и перевозке материалов, особенно морем. Гигроскопичность объясняется отсыревание и даже расплывание ряда солей при хранении на воздухе. Некоторые гигроскопические вещества (например, концентрированную серную кислоту) применяют для осушения воздуха.
Моющее действие, свойство ПАВ, диспергированных в воде или органическом растворителе, очищать поверхности твердых тел от загрязнений. Наиболее распространенные загрязнения-масляные (жировые) пленки с внедренными в них частицами пыли, сажи и т. п. К моющему действию относят также очистку поверхности раздела вода-воздух, например от разлившейся нефти. На практике моющее действие осуществляется многокомпонентными смесями ПАВ, наз. моющими средствами.
Мицелообразование, самопроизвольная ассоциация молекул ПАВ в растворе. В результате в системе ПАВ — растворитель возникают м и ц е л л ы-ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы. В т.наз. прямых мищеллах ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу. Число молекул ПАВ, образующих мицеллу, наз. числом агрегации; по аналогии с молекулярной массой мицеллы характеризуются и так называемой мицелляряной массой. Обычно числа агрегации составляют 50-100, мицеллярные массы равны 103-105. Образующиеся при мицеллообразовании мицеллы полидисперсные и характеризуются распределением по размерам (или числам агрегации).
| Мыло |
Критическая концентрация мицеллообразования при 50 °С, моль/л |
|
Лаурат натрия С11Н33СООNа |
2,8·10-2* |
|
Пальмитат натрия С15Н31СООNа |
2,1·10-3 |
|
Пальмитат калия С15Н31СООК |
2,2·10-3 |
|
Стеарат натрия С17Н35СООNа |
1,8·10-4 |
|
Стеарат калия С17Н35СООК |
5,0·10-4 |
|
Олеат натрия С17Н33СООNа |
1,1·10-3* |
|
Олеат калия С17Н33СООК |
1,2·10-3* |






